Добування кисню: основні методи, приклади та галузі використання
Чи пам’ятаєте той момент, коли ви глибоко вдихаєте після тривалої задухи? Саме кисень дарує нам це відчуття свіжості та життєвої енергії. Без цього невидимого газу життя на нашій планеті було б неможливим.
Кисень — газ без кольору, смаку та запаху, який становить майже п’яту частину повітря навколо нас. Це життєво важливий елемент для дихання людей, тварин і більшості живих організмів. Кисень також відіграє ключову роль у багатьох природних процесах та широко використовується в промисловості.
Історія відкриття кисню
Історія відкриття кисню пов’язана з іменами трьох вчених. Шведський аптекар Карл Шеєле виділив кисень у 1772 році, нагріваючи оксид ртуті. Англійський хімік Джозеф Прістлі незалежно отримав цей газ у 1774 році схожим способом. Але саме французький вчений Антуан Лавуазьє дав елементу назву “оксиген” (той, що породжує кислоти) та вперше пояснив його роль у процесах горіння та дихання.
Фізичні та хімічні властивості кисню
У звичайних умовах кисень — це газ без кольору та запаху. При охолодженні до -183°C він перетворюється на рідину блакитного кольору. Кисень активно підтримує горіння — тліюча скіпка спалахує в ньому яскравим полум’ям. Це пояснюється його високою окиснювальною здатністю. Кисень реагує з більшістю елементів, утворюючи оксиди.
 Методи добування кисню
Методи добування кисню
Лабораторні методи
У школах та наукових лабораторіях кисень найчастіше отримують кількома способами.
Розклад гідроген пероксиду (перекису водню) — мабуть, найпростіший метод. Якщо додати до розчину H₂O₂ трохи манган(IV) оксиду як каталізатора, одразу почнеться бурхлива реакція з виділенням кисню. Це схоже на те, як шипуча таблетка в воді виділяє бульбашки газу.
Другий поширений спосіб — нагрівання калій перманганату (марганцівки). При нагріванні KMnO₄ розкладається з утворенням кисню. Так само при нагріванні розкладається і бертолетова сіль (KClO₃).
Промислові методи
У промисловості кисень добувають зовсім іншими методами через потребу у великих обсягах.
Основний промисловий метод — кріогенне розділення повітря. Спочатку повітря охолоджують до рідкого стану, а потім поступово нагрівають. Оскільки різні гази мають різні температури кипіння, їх можна розділити. Кисень кипить при вищій температурі, ніж азот, тому його збирають окремо.
Інший промисловий метод — електроліз води. Пропускаючи електричний струм через воду, можна розділити її на кисень та водень.
Способи збирання кисню
Зібрати кисень у лабораторії можна двома основними способами.
Метод витіснення води: Газоподібний кисень направляють у перевернуту пляшку, наповнену водою. Кисень витісняє воду і заповнює пляшку.
Метод витіснення повітря: Оскільки кисень важчий за повітря, його можна зібрати, направляючи потік газу знизу у порожню ємність.
 Доведення наявності кисню
Доведення наявності кисню
Найпростіший спосіб виявити кисень — випробування з тліючою скіпкою. Якщо внести тліючу скіпку в посудину з киснем, вона яскраво спалахне. Це відбувається тому, що кисень підтримує горіння краще, ніж повітря.
Застосування кисню
Кисень застосовують у багатьох сферах нашого життя.
У медицині кисневі маски та балони допомагають пацієнтам з проблемами дихання. Кожен з нас бачив, як у фільмах рятувальники надають кисень людям після пожежі.
У металургії кисень використовують для зварювання та різання металу. Жаркий кисневий потік ріже метал, як ніж масло.
У космонавтиці рідкий кисень служить окисником ракетного палива, забезпечуючи політ космічних кораблів.
Кисень — один з найважливіших елементів у нашому житті. Методи його добування постійно вдосконалюються, що робить його доступнішим для використання в різних галузях. Щоразу, коли ми вдихаємо, варто згадати про цей дивовижний елемент, який підтримує життя на нашій планеті.
Спробуйте провести простий дослід з перекисом водню та дріжджами вдома — ви зможете самі побачити, як утворюється кисень, і краще зрозуміти його властивості.
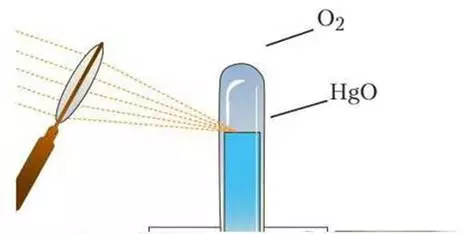 Методи добування кисню
Методи добування кисню Доведення наявності кисню
Доведення наявності кисню